Penurunan Titik Beku - Seperti halnya pada kenaikan titik didih, adanya zat terlarut dalam larutan akan mengakibatkan titik beku larutan lebih kecil daripada titik beku pelarutnya. Penurunan titik beku ΔTf (f berasal dari kata freeze) berbanding lurus dengan molalitas (m) larutan:
ΔTf ∞ m atau ΔTf = Kf . m
dengan Kf adalah tetapan penurunan titik beku molal pelarut (°C/m). Penurunan titik beku (Tf) adalah titik beku pelarut murni (Tf°) dikurangi titik beku larutan (Tf).
ΔTf = Tf° - Tf
Berikut ini adalah beberapa harga tetapan penurunan titik beku (Kf) dari beberapa pelarut dalam Tabel Tetapan Penurunan Titik Beku (Kf) Beberapa Pelarut.
Contoh Soal Penurunan Titik Beku
Beberapa contoh soal dan penyelesaian dari penurunan pada titik beku berikut ini:
Contoh Satu
Berapakah titik beku larutan yang terbuat dari 10 g urea CO(NH2)2 dalam 100 g air? (massa molar urea 60 g/mol, Kf air = 1,86 °C/m)
Jawab:
ΔTf = Kf . m
= 1,86 °C/m × 1,7 m
= 3,16 °C
Jadi, larutan tersebut memiliki titik beku 3,16 °C di bawah 0 °C atau pada –3,16 °C.
Contoh Dua Penurunan Titik Beku
Hitunglah titik beku larutan yang terdiri atas 10 gram glukosa (Mr = 180 g/mol) dalam 500 g air (Kf air = 1,86 °C/m).
Jawab:
ΔTf = Kf . m
= 1,86 °C/m × 0,11 m
= 0,20 °C
Titik beku larutan
ΔTf = Tf air – Tf larutan
0,20 °C = 0 – Tf larutan
Tf larutan = – 0,20 °C
Jadi, titik beku larutan adalah – 0,20 °C.
Contoh Tiga
Hitunglah titik beku suatu larutan yang mengandung 2 g kloroform, CHCl3 (Mr = 119 g/mol) yang dilarutkan dalam 50 g benzena (Kf benzena = 5,12 °C/m, Tf benzena = 5,45 °C).
Jawab:
ΔTf = Kf . m
= 5,12 °C/m × 0,34 m
= 1,74 °C
Titik beku larutan
ΔTf = Tf benzena – Tf larutan
1,74 = 5,45 – Tf larutan
Tf larutan = 3,71 °C
Jadi, titik beku larutan tersebut adalah 3,71 °C.
Contoh Empat
Larutan yang dibuat dengan melarutkan 5,65 g suatu senyawa yang tidak diketahui dalam 110 g benzena membeku pada 4,39 °C. Berapakah massa molar senyawa tersebut?
Jawab:
Melalui tabel diketahui titik beku benzena = 5,45 °C dan Kf benzena = 5,12 °C/m
ΔTf = 5,45 °C – 4,39 °C = 1,06 °C
ΔTf = Kf . m
0,207 m artinya setiap kg benzena pada larutan mengandung 0,207 mol zat terlarut maka jumlah mol pada 110 g benzena dapat dihitung.
Jadi, massa 1 mol zat terlarut tersebut adalah 245,65 g.
Lihat juga:
Gejala penurunan titik beku juga memiliki terapan praktis di antaranya adalah penurunan titik beku air. Zat antibeku (biasanya etilen glikol) yang ditambahkan ke dalam sistem pendingin mesin mobil mencegah pembekuan air radiator pada musim dingin. Penggunaan CaCl2 dan NaCl untuk menurunkan titik leleh es juga sering diterapkan, misalnya untuk menyiapkan campuran pendingin dalam pembuatan es krim.
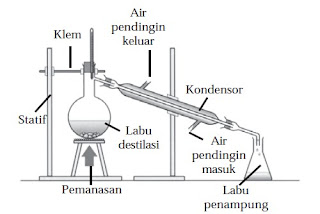 |
| Alat distilasi dirancang dengan menggunakan prinsip hukum Raoult |
Contoh penerapan Hukum Raoult digunakan pada alat distilasi untuk memisahkan campuran berdasarkan perbedaan titik didihnya.
Demikian penjelasan mengenai Penurunan Titik Beku yang dapat kami share pada kesempatan kali ini, semoga berkah dan bermanfaat.









