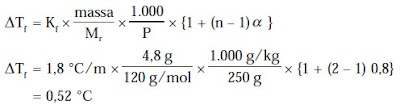Rangkuman Materi Sifat Koligatif Larutan - Berikut ini RumusKimia.net akan share Rangkuman Materi Sifat Koligatif Larutan. Rangkuman materi ini merupakan garis besar dari pembahasan yang telah kami share sebelumnya sehingga dapat sahabat jadikan sebagai pengingat kembali materi yang telah sahabat pelajari sebelumnya. Tapi jika sahabat membutuhkan penjelasan dari setiap materi khusus dalam pembahasan utama Sifat Koligatif Larutan, sahabat dapat mempelajarinya kembali materi per materi.
Baca juga: Tata Nama Eter Dilengkapi Contoh Penamaanya.
Rangkuman Materi Sifat Koligatif Larutan
Berikut rangkuman materinya:
1. Molalitas
Molalitas adalah besaran yang berguna untuk menghitung jumlah zat terlarut yang dinyatakan dalam mol dan jumlah pelarut dalam kilogram.
2. Fraksi mol
Fraksi mol merupakan satuan konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Total fraksi mol = 1
3. Sifat koligatif larutan nonElektrolit
Sifat koligatif bergantung pada jumlah zat yang terlarut pada larutan. Sifat koligatif terdiri atas penurunan tekanan uap (ΔP), kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf), dan tekanan osmotik.
a. Penurunan tekanan uap (ΔP)
b. Kenaikan titik didih (ΔTb)
ΔTb= Kb × m atau ΔTb = Tb – Tbo
c. Penurunan titik beku (ΔTf)
ΔTf = Kf × m atau ΔTf = Tfo – Tf
d. Tekanan osmotik (π)
π = MRT
[Lihat Selengkapnya:
- Penurunan Tekanan Uap Sifat Koligatif Larutan Nonelektrolit.
- Kenaikan Titik Didih Sifat Koligatif Larutan Nonelektrolit.
- Penurunan Titik Beku Sifat Koligatif Larutan Nonelektrolit.
- Tekanan Osmotik Larutan Nonelektrolit.]
4. Sifat koligatif larutan elektrolit
Sifat koligatif larutan elektrolit bergantung pada bilangan faktor Van’t Haff. Jadi, perhitungan penurunan tekanan uap, kenaikan titik didih, dan tekanan osmotik dikalikan dengan faktor Van’t Hoff (i).
i = 1 + (n – 1)α
a. Penurunan tekanan uap jenuh
ΔP = xBP° {1 + (n – 1) α}
b. Kenaikan titik didih
ΔTb = Kb.m.i atau ΔTb = Kb.m.{1 + (n – 1) α}
c. Penurunan titik beku
ΔTf = Kf .m.i atau ΔTf = Kf.m.{1 + (n – 1) α}
d. Tekanan osmotik
π = MRT.i atau π = MRT {1 + (n – 1) α}
[Lihat Selengkapnya:
Demikian Rangkuman Materi Sifat Koligatif Larutan yang dapat kami rangkum pada kesempatan kali ini, dan nantikan rangkuman materi kimia lainnya hanya di RumusKimia.net.
- Sifat Koligatif Larutan Elektrolit.
- Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit.
- Rumus dan Contoh Soal Tekanan Osmotik Larutan Elektrolit.]
Demikian Rangkuman Materi Sifat Koligatif Larutan yang dapat kami rangkum pada kesempatan kali ini, dan nantikan rangkuman materi kimia lainnya hanya di RumusKimia.net.
Pustaka:
[Kimia Kelas 12 IPA oleh Iman Rahayu 2009]
[Rumus Kimia]