Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit - Sahabat RumusKimia.net, kali ini kami akan share kepada sahabat bagaimana rumus dan contoh soal penurunan tekanan uap jenuh, kenaikan titik didih, dan penurunan titik beku khusus untuk larutan elektrolit.
 |
| Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit |
Sebagaimana kita ketahui bersama bahwa hubungan sifat koligatif larutan elektrolit dan konsentrasi larutan dirumuskan oleh Van’t Hoff, yaitu dengan mengalikan rumus yang ada dengan bilangan faktor Van’t Hoff yang merupakan faktor penambahan jumlah partikel dalam larutan elektrolit.
Baca juga:
Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit
Untuk lebih jelasnya dari rumus dan contoh soalnya, berikut ulasannya khusus sahabat:
1) Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van’t Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh karena itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit adalah:
ΔP = xBP° {1 + (n – 1)α }
Perhatikanlah contoh soal penerapan rumus tekanan uap untuk zat elektrolit
berikut.
Contoh Soal
Hitunglah tekanan uap larutan NaOH 0,2 mol dalam 90 gram air jika tekanan uap air pada suhu tertentu adalah 100 mmHg!
Jawab:
Karena NaOH merupakan elektrolit kuat (α = 1) dan n = 2 maka
ΔP = xBP° {1 + (n – 1)α }
= 100 × 0,038 {1 + (2 – 1)1}
= 7,6 mmHg
Tekanan uap larutan = 100 mmHg – 7,6 mmHg
= 92,4 mmHg
Jadi, tekanan uap larutan NaOH adalah 92,4 mmHg.
2) Rumus dan Contoh Soal Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit
Seperti halnya penurunan tekanan uap jenuh, rumus untuk kenaikan titik didih dan penurunan titik beku untuk larutan elektrolit juga dikalikan dengan faktor Van't Hoff.
Contoh Soal
Perhatikanlah contoh-contoh soal berikut.
Sebanyak 4,8 gram magnesium sulfat, MgSO4 (Mr = 120 g/mol) dilarutkan dalam 250 g air. Larutan ini mendidih pada suhu 100,15 °C. Jika diketahui Kb air 0,52 °C/m, Kf air = 1,8 °C/m, tentukan:
a. derajat ionisasi MgSO4;
b. titik beku larutan.
Jawab:
a. Reaksi ionisasi MgSO4 adalah MgSO4(s) → Mg2+(aq) + SO42-(aq) (n = 2)
Kenaikan titik didih:
ΔTb = Tb larutan – Tb air
= 100,15 °C – 100 °C = 0,15 °C
Jadi, derajat ionisasi MgSO4 adalah 0,8.
b. Untuk menghitung titik bekunya, kita cari dulu penurunan titik bekunya dengan rumus:
Tf larutan = Tf air – ΔTf
= 0 °C – 0,52 °C = –0,52 °C
Jadi, titik beku larutan tersebut adalah –0,52 °C.
Itulah Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit yang dapat kami bagikana pada kesempatan kali ini, semoga dapat memberikan manfaat dan dimanfaat dalam pengembangan ilmu pengetahuan Kimia. - RumusKimia.net
Pustaka:
[Kimia IPA Kelas 12 Iman Rahayu]
[Google Images]



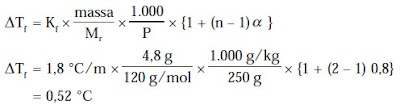
0 Response to "Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit"
Post a Comment